



Identificación y caracterización de enfermedades en Cannabis sativa L.
Identification and characterization of diseases in Cannabis sativa L.
Temas Agrarios
Universidad de Córdoba, Colombia
ISSN: 0122-7610
ISSN-e: 2389-9182
Periodicidad: Semestral
vol. 27, núm. 1, 2022
Recepción: 25 Mayo 2022
Aprobación: 03 Junio 2022

Resumen: El cultivo de Cannabis medicinal es uno de los principales renglones agrícolas en crecimiento de Colombia, sin embargo, el aumento de las áreas de producción y la intensificación del cultivo trae consigo la mayor predisposición a la aparición de plagas y enfermedades. El objetivo del trabajo fue identificar las principales enfermedades asociadas a un cultivo comercial de cannabis bajo invernadero y en alta densidad de siembra. Se caracterizaron los síntomas de enfermedades presentes en el cultivo durante un año de producción. Se tomaron muestras en las diferentes fases fenológicas y áreas de la finca como: propagación, lotes de producción y de poscosecha. Se colectaron un total de 43 muestras entre tejido enfermo, suelo, compost, sustratos y aguas. El mayor porcentaje de las muestras colectadas correspondier on a tejidos de esquejes que presentaron damping off (28%), seguidos de muestras con síntomas de lesión foliar con halo clorótico (19%). Se obtuvieron 26 aislamientos puros de hongos fito patógenos, caracterizados morfológica y molecularmente correspondientes a Botrytis cinerea (8%), Sclerotinia sclerotiorum (15%), Fusarium sp. (46%), Bipolaris sp. (12%), Rhizoctonia solani (8%) y Corynespora casiicola (8%) causando enfermedades al cultivo. Síntomas asociados a damping off, revelaron la presencia de Rhizoctonia solani provocando estrangulamiento y pudrición en la base del esqueje. Se reportaron tres especies de Fusarium: Fusarium fujikuroi, Fusarium oxysporum y Fusarium graminearum, este último asociado a la pudrición en la base del tallo. Otro de los problemas con mayor incidencia fue la mancha foliar asociada a la presencia de Bipolaris sp. y Corynespora casiicola.
Palabras clave: Corynespora casiicola, Cannabis, Enfermedades foliares, Fusarium graminearum..
Abstract: The medicinal Cannabiscrop is one of the main growing agricultural activities in Colombia. However, the increase in production areas and the intensification of crops brings a greater predisposition to pests and diseases incidence. The objective of this research was to identify the main diseases associated with a high-density commercial Cannabis crop in a greenhouse. Samples of disease symptoms present in the crop during a round year of production were characterized. Samples were taken in different phenological phases and areas of the farm such as: propagation areas, field production and post-harvest. A total of 43 samples were collected among diseased tissue, soil, compost, substrates, and water. Damping off was present in the highest percentage of samples collected from cuttings (28%), followed by samples affected with leaf spot chlorotichalo symptoms (19%). 26 pure isolates of phytopathogenic fungi were obtained, and morphologically and molecularly characterized causing diseases in the crop. They were consistent with Botrytis cinerea (8%), Sclerotinia sclerotiorum (15%), Fusarium sp. (46%), Bipolaris sp. (12%), Rhizoctonia solani (8%) and Corynespora casiicola (8%). Symptoms associated with damping off or wilt tissues revealed the presence of Rhizoctonia solani causing strangulation and cutting rot at the base. Three species of Fusarium were reported: Fusarium fujikuroi, Fusarium oxysporum and Fusarium graminearum, the latter associated with stem end rot. Leaf spot associated with Bipolaris sp. and Corynespora casiicola was present at a high incidence.
Keywords: Corynespora casiicola, Cannabis, Plant diseases, Fusarium graminearum.
INTRODUCCIÓN
El Cannabis (Cannabis sativa L.) es una importante especie herbácea originaria de Asia Central, que se ha utilizado por más de 5000 años en la medicina popular y como fuente de fibra textil (Booth y Bohlmann, 2019). Su producto más valioso hoy en día es la resina rica en terpenos y cannabinoides los cuales exhiben diversas propiedades psicoactivas y medicinales (Baron, 2018). En Colombia el cultivo de Cannabis con fines medicinales representa una alternativa productiva que se encuentra enmarcada en la Ley 1787 de 2016. Las cifras de este mercado son optimistas e indican que el mercado legal de cannabis del mundo, estimado en 12.000 millones de dólares en 2018, podría llegar a los 166.000 millones de dólares en 2025 (Portafolio, 2020).
El aumento en la producción comercial del cultivo de cannabis, los sistemas de producción intensiva, bajo invernadero y altas densidades pueden provocar un incremento en los insectos plaga y los agentes patógenos (incluso la aparición de nuevos agentes que no han sido previamente descritos) que pueden afectar negativamente el rendimiento y la calidad del cultivo (Punja, 2018), y más en un cultivo intensivo como el Cannabis con fines farmacéuticos cuyas estrategias de control restringen la aplicación de productos de síntesis química.
A nivel mundial existen diferentes reportes de enfermedades asociadas al cultivo de Cannabis dentro de las que se encuentran las causadas por patógenos de raíz como F. oxysporum, F. solani, F. brachygibbosum, Pythiumdissotocum, P. myriotylum, y P. aphanidermatum. Patógenos foliares como Golovinomyces cichoracearum y patógenos de inflorescencias como Penicilliumolsonii, Penicilliumcopticola, Botrytis cinerea, F. solani, F. oxysporum (Punja et al., 2019).
Otros autores reportan el complejo de hongos causantes de "Damping off" en plántulas (Pythium ultimum, P. aphanidermatum, Botrytis cinérea, Macrophomina phaseolina, Rhizoctonia solani, Fusarium spp.) (Mcpartland, 2019) fungi, Haematonectria haematococca, plants Descriptor (s, moho gris en flor causado por Botrytiscinerea (Thiessen, 2019), mancha de hoja amarilla y marrón causadas por Septoria cannabis y S. neocannabina (Mushtaque et al., 1973), mildiu en hoja causado por Pseudoperonosporacannabina y P. humuli (McCain y Noviello, 1985), mancha oliva en hoja causado por Cercospora cannabis y Pseudocercosporacannabina, tizón marrón causado por Alternaria alternata, A. solani, A. longipes (Mcpartland, 2019) M.capricolum, M.mycoidessubsp. capri, M.mycoides subsp. mycoides of the large colony (LC, enfermedades bacterianas de hoja causadas por Xanthomonas campestris pv. Cannabis, podredumbre rosa causada por Trichotheciumroseum, chancro de cáñamo causado por Sclerotiniasclerotiorum (Bains et al., 2000), chancro por Fusarium, marchitamiento por F. oxysporum f. sp cannabis (McCain y Noviello, 1985), nemátodos de tallo como Ditylenchus sp. (Bakro et al.,2018), podredumbre carbonosa causada por Macrophominaphaseolina (Casano et al., 2018), antracnosis causada por Colletotrichum spp. (Szarka et al., 2020a), “Striatura ulcerosa” causada por Pseudomonas amygdali pv. mori (McPartland et al., 2000) M.capricolum, M.mycoides subsp. capri, M.mycoides subsp. mycoides of the large colony (LC, nematodos formadores de agallas en raíz causado por Meloidogyne spp. (Song et al., 2017), pudrición basal y de raíz por Rhizoctonia solani (McPartland y Cubeta, 1997), tizón del sur causado por Sclerotium rolfsii (Pane et al., 2007), enfermedades virales como Hemp streak virus y Hemp Mosaic virus (Righetti et al., 2018), pudrición blanca causada por Sclerotinia sclerotiorum (Bains et al., 2000), mancha foliar causada por Bipolaris sp. (Szarka et al., 2020b), entre otras.
Los estudios publicados enfocados a la caracterización de los patógenos del cultivo de Cannabis en Colombia son escasos (Rubiano Moreno, 2019), en ellos se reporta la presencia de problemas fitosanitarios que incluyen moho gris, mildeo polvoso y "Damping off" (Rivera-Hernández, 2020; Rosero, 2019).
El objetivo de este trabajo fue caracterizar los diferentes patógenos presentes en un sistema productivo comercial de Cannabis medicinal a partir de la colecta, aislamiento, identificación y pruebas de patogenicidad de los patógenos presentes en diferentes etapas de producción.
MATERIALES Y MÉTODOS
El trabajo se desarrolló en diferentes cultivos del departamento de Antioquia, caracterizados por su producción bajo invernadero y altas densidades. En cada cultivo se recorrieron las áreas de propagación, los lotes de producción y las áreas de poscosecha (presecado de flor). Las visitas se desarrollaron cada mes, por un periodo de 12 meses y se tomaron muestras de tejido con síntomas relacionados con enfermedades, suelo y sustratos empleados, así como las aguas utilizadas para riego. Cada material fue procesado de manera diferencial como se describe a continuación.
Tejido enfermo
Aislamientos directos de tejido enfermo: Para este tipo de aislamiento se identificaron las muestras de acuerdo con la sintomatología y en cada caso se estableció un protocolo de preparación y siembra en medio de cultivo.
Manchas oscuras pequeñas y con bordes regulares, rodeadas de halo amarillo y tizón en hojas: Se tomaron trozos de hoja con la lesión necrótica, estos se desinfestaron secuencialmente con hipoclorito de sodio al 2% (1 min), agua destilada estéril (1 min), etanol al 70% (1 min) y agua destilada estéril (1 min) y se sembraron dos trozos por caja en medio PDA pH 4,5. Otra muestra del tejido desinfestado se maceró en 200 µL de Agua destilada estéril (ADE), se tomaron 20 µL y se diluyeron en 1000 µL de ADE. Se sembraron 100 µL de la dilución en medio PDA + Tritón + Cloranfenicol y Agar nutritivo.
Micelio blanco y esclerocios en flor y tallo: Se tomaron esclerocios y se sembraron en medio PDA pH 4,5 previa desinfección. Se realizaron además cortes de tallo o tejido de flor donde se evidenciará presencia de micelio blanco y se sembraron en PDA pH 4,5.
"Damping off" y marchitamiento con clorosis: Se tomaron trozos de tallos, se desinfestaron y se maceraron en ADE (200 µL). Se tomaron 20 µL y se adicionaron a 1000 µL de ADE. Se inoculó en medio Cruces con Arveja (Selectivo para Oomycetes) con 100 µL de la dilución.
Marchitamiento con clorosis y tallo rosado: Se tomaron secciones de tallos cortadas longitudinalmente y hojas, esto se desinfestó secuencialmente con hipoclorito de sodio al 0,5% (30 s), agua destilada estéril (1 min), etanol al 70% (20 s) y tres lavados con agua destilada estéril. Se sembraron dos trozos por caja en medio PDA + Cloranfenicol.
Las muestras se incubaron en oscuridad a 25oC durante 7 días. El micelio generado de los aislamientos de los tejidos o la siembra de las diluciones se repicó en el mismo medio de cultivo.
Moho gris: Se desinfestaron secuencialmente trozos de tejido con el síntoma y se sembraron en medio PDA pH 4,5 (Dos trozos por placa con medio de cultivo).
Cámaras húmedas
En cajas de Petri con una servilleta húmeda se colocó el tejido enfermo sobre un portaobjetos y se dejó durante 48 horas en cámara húmeda. El micelio generado sobre la superficie del tejido se sembró en medio PDA pH 4,5. Los aislamientos se incubaron en oscuridad a 25ºC durante 7 días. El micelio generado de los aislamientos de los tejidos o la siembra de las diluciones se repicó en el mismo medio de cultivo.
Agua, suelo, compost y sustratos.
Se tomaron 10 g o 10 ml de la muestra y se agregaron en 90 ml de solución salina NaCl al 0,85%. La suspensión se dejó en agitación durante 1 hora para posteriormente realizar diluciones seriadas. Las diluciones 10-2 a 10-5 se sembraron por triplicado en medio PDA + Tritón + Cloranfenicol y Agar Nutritivo (100 µL por caja). Para el caso de las muestras de agua las diluciones 100 a 10-2 se sembraron por triplicado en medio PDA + Tritón + Cloranfenicol y Agar Nutritivo (100 µL por caja).
Las muestras se incubaron en oscuridad a 25oC durante 7 días. Día en el cual se realizó el recuento de unidades formadoras de colonia en cada una de las diluciones.
Se realizaron montajes directos del tejido con el síntoma y se tomaron improntas de los aislamientos puros para observar al microscopio estructuras características. Se realizó además Tinción de Gram a los aislamientos bacterianos.
Caracterización de los aislamientos
Las colonias puras de cada uno de los aislamientos fueron caracterizadas morfológicamente (macroscópica y microscópica) y molecularmente. Se realizó extracción de ADN siguiendo la metodología propuesta por Griffith y Shaw, (1998) y posteriormente se realizó amplificación por PCR empleando los primers ITS1F-ITS4 (ITS1-F 5ʹ-CTTGGTCATTTAGA- GGAAGTAA-3ʹ y ITS4 5ʹ-TCCTCCGCTTA-TTGATATGC-3ʹ). Las secuencias resultantes fueron comparadas con la región ITS1-5.8S-ITS2 correspondiente de las secuencias de la Base de datos GenBank del Centro Nacional para La Información Biotecnológica (NCBI). Los biotipos de hongos se conservaron en medio PDA a -4ºC (3 copias de cada uno y en Crioviales en solución de crioconservación (Glicerol 20% y Peptona al 0.5%) a -80ºC.
Pruebas de patogenicidad
Para los aislamientos obtenidos de tejido con mancha foliar, "Damping off", moho gris y pudrición blanca, se estandarizaron protocolos de pruebas de patogenicidad para garantizar la identificación del patógeno e identificar dentro de los aislados aquellos con mayor capacidad patogénica y/o virulencia. Dependiendo del patógeno las pruebas de patogenicidad consistieron en aplicar en forma de inmersión de raíces o en spray al tejido foliar, cantidades específicas de las estructuras reproductivas de cada hongo (conidias), cuantificadas y obtenidas a partir de cultivos monospóricos.
RESULTADOS Y DISCUSIÓN
Se colectaron un total 43 muestras entre tejido enfermo, suelo, compost, sustratos y aguas. El mayor porcentaje de las muestras colectadas correspondieron a tejidos de esquejes que presentaron “Damping off” (28%), seguidos de muestras con síntomas de mancha foliar con halo clorótico (19%), plantas con marchitamiento (12%), tallo con micelio y esclerocios (7%), pudrición blanca (7%), esclerocios en flor (5%), raíces con agallas (5%), tizón borde de hoja (5%), bronceado en hoja (2%), tallo hueco (2%), micelio blanco en flor (2%), moho gris en flor (2%), mildeo velloso en hojas (2%) y mildeo blanquecino en hojas (2%).
El mayor porcentaje de las muestras fueron colectadas en los bloques de producción donde se encontraron la mayoría de las enfermedades (53%). El 21% de las muestras fueron tomadas en las áreas de plantulación, el 9% en los módulos de investigación, el 7% en las áreas de compostaje, el 5% en presecado y el 2% en los bloques de plantas madre.
De otro lado la mayor cantidad de muestras fueron tomadas de hojas (33%) y tallos (28%). En este último se evidenciaron la mayor cantidad de síntomas que incluyeron damping off, micelio en tallo, pudrición blanca, marchitamiento, moho gris y tallo hueco. Las muestras de sustratos (9%) y aguas (7%) fueron tomadas de zonas donde se presentaba la enfermedad. El resto de las muestras fueron tejidos de raíz (5%), compost (5%), suelo (5%) y flor (9%).
En total se obtuvieron 26 aislamientos puros de hongos fitopatógenos, caracterizados morfológica y molecularmente correspondientes a Botrytiscinerea (8%), Sclerotiniasclerotiorum (15%), Fusarium sp. (46%), Bipolaris sp. (12%), Rhizoctoniasolani (8%) y Corynespora casiicola (8%). Se encontró adicionalmente un aislamiento de Chaetomium globosum el cual fue descartado como fitopatógeno por la sintomatología presentada en la planta.
El 27% de los aislamientos fueron obtenidos de tejidos con síntomas de mancha foliar, el mismo porcentaje fue aislado de plantas con marchitamiento o sustratos y suelo donde se encontraban las plantas con dicha sintomatoogía, el 19% de los microorganismos fueron aislados de plántulas con "Damping off", el 24% de flores o tallos con micelio blanco y el 4% restante de flores con moho gris.
Un porcentaje representativo correspondiente a más del 50% de los aislamientos se obtuvieron de bloques de producción. Solo el 24% restante correspondieron a aislamientos de hongos provenientes de las zonas de confinamiento (8%), presecado (8%) y módulos de investigación (8%).
El 38% de los hongos fueron aislados de tallo, tejido donde se presentó la mayor variabilidad de síntomas. Con frecuencia se obtuvieron aislamientos de patógenos que aparentemente no correspondían al síntoma descrito, aun así, los aislamientos fueron purificados y caracterizados. El 8% de los aislamientos fueron obtenidos de tejidos de raíz, el 35% de hojas, el 4% de suelo y el 15% de flores.
El hecho de que se haya obtenido un mayor número de aislamientos en las muestras con síntomas de mancha foliar y marchitamiento se debió principalmente a que en todos los tejidos con el mismo síntoma se obtenía diferentes géneros de hongos caracterizados morfológicamente y no se evidenciaba una tendencia en la obtención del mismo aislamiento en cada muestra (Tabla 1). Esto posiblemente se debe a que usualmente se estaban aislando organismos de tejidos internos que incluían organismos endófitos naturales de la planta o provenientes de aplicados de insumos biológicos en el cultivo. Los aislamientos reportados como biocontroladores como Trichoderma spp. y Bacillus spp. encontrados en este estudio fueron descartados como agentes causales de enfermedad (Omari et al., 2016).
| Aislamiento | Síntoma | Lugar de colecta | Caracterización molecular |
| C-Flor | Moho en flor | Bloque de producción | Fusariumgraminearum |
| MTHA | Mancha foliar en hoja | Bloque de producción. | Fusariumgraminearum |
| 2071219 | Tallo con micelio | Bloque de producción. | Fusariumgraminearum |
| 2771219 | "Damping Off" en esquejes | Confinamiento. | Fusarium graminearum |
| F-Tallo | Marchitamiento | Bloque de producción. | Fusarium oxysporum |
| 3171219 | Suelo donde hay plantas con síntomas de marchitamiento | Bloque de producción | Fusarium oxysporum |
| 171219 | "Damping off" en esquejes | Confinamiento | Fusarium fujikuroi |
| D-Tallo | Marchitamiento | Bloque de producción | Fusarium oxysporum |
| 18819-1 | "Damping Off" en esquejes | Confinamiento | Rhizoctonia solani |
| 18819-2 | "Damping Off" en esquejes | Confinamiento | Fusarium oxysporum |
| 28819 | Marchitamiento, tallo rosado | Bloque de producción | Fusarium graminearum |
| 8819 | Marchitamiento, micelio en hoja | Bloque de producción | Fusarium graminearum |
| 1771219 | Mancha foliar en hoja | Bloque de producción . | Bipolaris sp. |
| 1007 B1A | Mancha foliar en hoja | Bloque de producción | Bipolaris sp. |
| 1003 B1A | Mancha foliar en hoja | Bloque de producción | Bipolaris sp. |
| 1971219 | Mancha foliar en hoja | Bloque de producción | Corynespora cassicola |
| 2671219 | Moho gris parduzco en flor | Bloque de producción | Botrytis cinerea |
| 1011 Bo | Mancha foliar y moho gris en tallo | Bloque de producción | Botrytis cinerea |
| 2571219 | Micelio blanco en tallo | Bloque de producción | Sclerotinia sclerotiorum |
| 571219 | Moho blanco, esclerocio blando en flor | Presecado | Sclerotinia sclerotiorum |
| 871219 | Micelio y esclerocios en tallo | Bloque de producción | Sclerotinia sclerotiorum |
| 671219 | Micelio blanco pegado en flor | Presecado | Sclerotinia sclerotiorum |
| 271219 | Mildeo polvoso en hoja | Bloque de producción | Erysiphe sp. y Sphaeroteca sp. |
| 1671219 | Mildeo velloso en hoja | Bloque de producción | Peronospora sp. |
Hongos de los géneros Fusarium, Sclerotinia, Rhizoctonia y Botrytis han sido previamente reportados como patógenos en plantas de Cannabis (Ferrell y Thiessen, 2019; Mcpartland, 2019; Punja, 2018; Thiessen, 2019; Wang, 2018) M. capricolum, M. mycoides subsp. capri, M. mycoides subsp. mycoides of the large colony (LC y por lo tanto, fueron tomados en este estudio para hacer la determinación de síntomas, caracterización y pruebas de patogenicidad.
A continuación, se presentan los principales síntomas, signos y caracterización de los microorganismos patógenos encontrados en el sistema.
La podredumbre marrón o moho gris en flor y tallos fue causada por Botrytiscinerea (Figura 1). Estos resultados corroboran lo reportado por Punja (2018) quien atribuye la pudrición marrón en inflorescencias de Cannabis al patógeno Botrytiscinerea y podredumbre interna a F. solani. En el presente trabajo la pudrición marrón o moho gris en la flor también correspondió a Botrytiscinerea sin embargo no se obtuvieron aislamientos de F. solani colonizando el tejido, si no, de F. graminearum y F. oxysporum, estos últimos posibles agentes causales del marchitamiento de plantas adultas (Thiessen, 2019).
Los síntomas de moho gris en flor y tallo encontrados en el sistema de producción son similares a los reportados por Mcpartland, (2019) y Scott et al., (2018) en cáñamo quienes indican lesiones húmedas en todas las partes de la planta, incluidos los tallos, las hojas y las flores. Las lesiones de las hojas y las flores eventualmente se vuelven necróticas y producen una masa de esporas grises.
En el presente trabajo cuando los tallos o ramas estaban infectados, las lesiones podían rodear el tallo y causar la rotura de las extremidades o del tallo (Figura 1a). De manera similar a las infecciones de hojas y flores, los tejidos necróticos se encontraban cubiertos con una estera de esporas grises e incluso esclerocios negros. Esto podría explicar porque se obtuvieron aislamientos de Botrytiscinerea no solo en flores sino también en hojas.
Algunos autores reportan a Botrytis cinérea como causante de damping off en plántulas de Cannabis o esquejes sin enraizar en condiciones de alta humedad y baja temperatura (Ferrell y Thiessen, 2019). Sin embargo, en nuestras observaciones no se identificaron aislamientos de Botrytis provenientes de plántulas con "Damping off", pero fue recurrente la observación de crecimiento superficial de este hongo en esquejes en enraizamiento; por tanto, se decidió realizar las pruebas de patogenicidad de Botrytiscinerea sobre esquejes e inflorescencias.
Se confirmó que los síntomas de pudrición blanca y esclerocios en tallo e inflorescencias fueron atribuidos a Sclerotiniasclerotiorum (Figura 1cde). Los síntomas causados por este patógeno comienzan como lesiones húmedas en tallos y ramas de plantas cerca de la madurez. Las lesiones colapsan en chancros y se decoloran de forma oscura. Las áreas afectadas adquieren una apariencia triturada y la médula se llena con un micelio blanco algodonoso. Las plantas permanecen en esta condición o se marchitan y se caen. Los esclerocios negros generalmente se forman en la superficie del tallo y pueden a llegar a la inflorescencia. Si la floración ha comenzado ha comenzado, a menudo cesa.

Por su parte el micelio blanco que se encontró sobre las inflorescencias de Cannabis en las etapas de producción y presecado se relacionó con los hongos Fusarium graminearum y Sclerotinia sclerotiorum. Estos resultados difieren a lo reportado por Punja (2018) quienes detectaron micelio de los hongos F. oxysporum, F. equiseti, Penicilliumolsonii, P. copticola y Aspergillus niger sobre botones florales de plantas de Cannabis sativa. Sin embargo, Ferrell y Thiessen (2019) y Thiessen (2019) indican que los patógenos F. gramineraum y S. sclerotiorum generan un moho sobre los botones florales.
La mancha foliar caracterizada por presentar puntos blancos con halo clorótico fue atribuida a Bipolaris sp. y Corynespora casiicola de la cual se obtuvieron cinco aislamientos. Es la primera vez que se reporta Corynespora casiicola como causante de mancha foliar en plantas de Cannabis (Figura 2).
Otros autores reportan como agentes causales de mancha foliar a Septoria cannabis, S. neocannabina, Cercosporacannabis y Pseudocercosporacannabina (McPartland, 2019) M.capricolum, M.mycoides subsp. capri, M.mycoides subsp. mycoides of the large colony LC. En el presente estudio no se encontraron aislamientos de estas especies.
A pesar de que Bipolaris spp. y Corynespora casiicola no han sido reportados en Cannabis, si se han reportado como causantes de mancha foliar en otras especies que incluyen Arachis ipogea, Avena sativa, Brassica compestris, Cicer arientenum, Glycine max, Halianthus annus, Hordeum vulgare, Lens culinaris,Oryza sativa, Pennisetum amaricanum, Sesamum indicum, Sorghum bicolor, Vigna mungo, Vigna radiata, y Zea mays para el caso de Corynespora casiicola (Dixon et al., 2009) y Cebada (Hordeum), arroz (Oryza), avena (Avena) maíz (Zea), Agropyron, Agrostis, Bromus, Calamagrostis, Cucumis, Echinochloa, Glycine, Hierochloe, Lolium, Lycopersicon, Medicago, Phleum, Poa, SchizachyrSecale, Setaria, Sorghum, Spartina y Trifolium para Bipolaris sp. (Iftikhar et al., 2009).

El diagnóstico en repetidas ocasiones de los síntomas asociados a "Damping off" o de muestras de plantas y tejidos con marchitamiento, tanto en la zona de confinamiento y en otras áreas de producción reveló la presencia de Rhizoctonia solani y tres especies de Fusarium: Fusariumfujikuroi, Fusariumoxysporum y Fusarium graminearum. Estos aislamientos conforman el clásico complejo de hongos causantes de "Damping off" reportado en Cannabis y muchas otras especies previamente reportadas (Mcpartland, 2019; McPartland et al., 2000; Thiessen, 2019; Wang, 2018) Con excepción de Botrytiscinerea, oomycetes como Pythium no fueron encontrados durante el proceso de aislamiento e identificación. En muestras con "Damping off" se reconocieron dos síntomas característicos: estrangulamiento en cuello y pudrición en la base del esqueje sin enraizar. Un aislamiento diferencial de estos dos tejidos permitió identificar a Rhizoctoniasolani como agente causal del estrangulamiento y F. graminearum en la pudrición en la base (Figura 3).
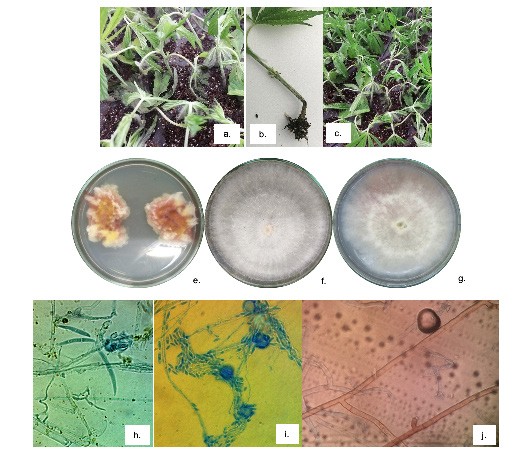
Los síntomas de podredumbre marrón y moho gris en flor y tallo pueden presentarse en todas las etapas del sistema de producción. En la etapa de confinamiento pueden causar "Damping off" y muerte del esqueje en condiciones de baja temperatura y alta humedad relativa. En el resto de las etapas las lesiones pueden rodear el tallo y causar la rotura de las extremidades o del tallo. Los síntomas de pudrición blanca son más frecuentes en las etapas de plantas madre y en plantas adultas durante la fase reproductiva en la cual se puede llegar a presentar moho blanco con esclerocios en la flor. Por su parte, síntomas de mancha foliar causados por Bipolaris sp. y Corynespora casiicola se pueden presentar en cualquier etapa del cultivo, sin embargo, la severidad de la enfermedad es mayor cuando las plantas son adultas y tienen entre 10 y 12 semanas de edad posteriores al trasplante.
Las especies de Fusarium spp. generan diferentes síntomas dependiendo de la etapa del sistema productivo. F. graminerarum puede ocasionar "Damping off" (pudrición en la base del esqueje), marchitamiento en plantas adultas y moho en la flor durante las fases productiva, cosecha y presecado. F. oxysporum es capaz de ocasionar "Damping off" en esquejes durante el proceso de enraizamiento y marchitamiento en plantas trasplantadas a campo. Finalmente, los síntomas de R. solani son restringidos a la etapa de enraizamiento de esquejes donde se puede presentar estrangulamientos de este.
De tejidos con síntomas de mildiu se reconocieron estructuras características de Erysiphe sp. y Sphaeroteca sp (mildeo polvoso) y Peronospora sp. (mildeo velloso) (Figura 4).

CONCLUSIONES
Se identificaron y caracterizaron los diferentes agentes causales de enfermedades en un sistema de producción de cannabis en invernadero bajo altas densidades en distintas áreas de producción. Este trabajo permite aproximarse al control de los patógenos en el cultivo de cannabis de una manera más apropiada al conocerse los agentes causales específicos.
RECOMENDACIONES
Se recomienda continuar con la investigación de los problemas fitosanitarios del cultivo, así como la caracterización de la resistencia o tolerancia de diversos materiales registrados a dichas enfermedades o plagas. Igualmente es importante avanzar con el desarrollo y evaluación de estrategias de manejo integrado y desarrollo de productos biológicos con registro para este tipo de cultivos.
REFRENCIAS
Bains, P. S., Bennypaul, H. S., Blade, S. F. and Weeks, C. 2000. First Report of Hemp Canker Caused by Sclerotinia sclerotiorum in Alberta, Canada. Plant Disease, 84(3), 372. https://doi.org/10.1094/PDIS.2000.84.3.372B
Bakro, F., Wielgusz, K., Bunalski, M. and Jedryczka, M. 2018. An overview of pathogen and insect threats to fibre and oilseed hemp (Cannabis sativa L .) and methods for their biocontrol. Integrated Control in Oilseed Crops, 136(September), 9–20.
Baron, E. P. 2018. Medicinal Properties of Cannabinoids, Terpenes, and Flavonoids in Cannabis, and Benefits in Migraine, Headache, and Pain: An Update on Current Evidence and Cannabis Science. Headache, 58(7), 1139–1186. https://doi.org/10.1111/head.13345
Booth, J. K. and Bohlmann, J. 2019. Terpenes in Cannabis sativa – From plant genome to humans. Plant Science, Vol. 284, pp. 67–72. https://doi.org/10.1016/j.plants-ci.2019.03.022
Casano, S., Cotan, A. H., Delgado, M. M., García-Tejero, I. F., Saavedra, O. G., Puig, A. A. and Santos, B. de los. 2018. First Report of Charcoal Rot Caused by Macrophomina phaseolina on Hemp (Cannabis sativa) Varieties Cultivated in Southern Spain. Plant Disease, 102(8), 1669.https://doi.org/10.1094/PDIS-01-18-0152-PDN
Dixon, L. J., Schlub, R. L., Pernezny, K. and Datnoff, L. E. 2009. Host specialization and phylogenetic diversity of coryne- spora cassiicola. Phytopathology, 99(9), 1015–1027. https://doi.org/10.1094/PHY-TO-99-9-1015
Ferrell, S. and Thiessen, L. 2019. Gray Mold of Industrial Hemp Industrial Hemp Disease Information. NC State Extension Publications, 1–6.
Griffith, G. W. and Shaw, D. S. 1998. Polymorphisms in Phytophthora infestans: Four mitochondrial haplotypes are detected after PCR amplification of DNA from pure cultures or from host lesions. Applied and Environmental Microbiology, 64(10), 4007–4014. https://doi.org/10.1128/aem.64.10.4007-4014.1998
Iftikhar, S., Asad, S., Munir, A., Sultan, A. and Ahmad, I. 2009. Hosts of Bipolaris sorokiniana, the major pathogen of spot blotch of wheat in Pakistan. Pakistan Journal of Botany, 41(3), 1433–1436.
McCain, A. H. and Noviello, C. 1985. Biological control of Cannabis sativa. Proceedings of the VI International Symposium on Biological Control of Weeds, 635–642. Ottawa Canada: Agriculture Canada.
Mcpartland, J. M. 2019. A review of Cannabis diseases. Journal of the International Hemp Association, 3(1), 19–23. Retrieved from http://www.internationalhempassociation.org/jiha/iha03111.html
McPartland, J. M., Clarke, R. C. and Watson, D. P. 2000. Hemp diseases and pests. CABI Publications, Wallingford, UK
McPartland, J. M. and Cubeta, M. A. 1997. New species, combinations, host associations and location records of fungi associated with hemp (Cannabis sativa). Mycological Research 101:853–857
Mushtaque, M., Baloch, G. M. and Ghani,M. A. 1973. Natural enemies of Papaver spp. and Cannabis sativa. In Annual re- port, Commonwealth Institute of Biologi- cal Control, Pakistan station.
Omari, D. F. D., Laline, B., Bruna, B. R., Edilaine, D. V. G.-T., Sidiane, C.-R., Emanuele, G. D. and Odair, J. K. 2016. Trichodermabean interaction: Defense enzymes activity and endophytism. African Journal of Agricultural Research, 11(43), 4286–4292. https://doi.org/10.5897/ajar2016.11687
Pane, A., Cosentino, S. L., Copani, V. and Cacciola, S. O. 2007. First Report of Southern Blight Caused by Sclerotium rolfsii on Hemp (Cannabis sativa) in Sicily and Southern Italy. Plant Disease, 91(5), 636.https://doi.org/10.1094/PDIS-91-5-0636A
Punja, Z. K. 2018. Flower and foliage-infecting pathogens of marijuana (Cannabis sativa L.) plants. Canadian Journal of Plant Pathology, 40(4), 514–527. https://doi.org/10.1080/07060661.2018.1535467
Punja, Z. K., Collyer, D., Scott, C., Lung, S., Holmes, J. and Sutton, D. 2019. Pathogens and Molds Affecting Production and Quality of Cannabis sativa L. Frontiers in Plant Science, 10(October), 1–23. https://doi.org/10.3389/fpls.2019.01120
Righetti, L., Paris, R., Ratti, C., Calassanzio, M., Onofri, C., Calzolari, D. and Grassi, G. 2018. Not the one, but the only one: about Cannabis cryptic virus in plants showing ‘hemp streak’ disease symptoms. European Journal of Plant Pathology, 150(3), 575–588. https://doi.org/10.1007/s10658-017-1301-y
Rivera-Hernández, J. F. 2020. Principales plagas y enfermedades asociadas al cultivo de Cannabis, cómo combatirlos? II Seminario Técnico La Agronomía Del Cannabis 2020. Bogotá D.C.
Rosero, A. A. 2019. SITUACION ACTUAL Y CANNABIS EN COLOMBIA Semilla certificada. ACOSEMILLAS, 32. Instituto Colombiano Agropecuario (ICA).
Rubiano Moreno, D. R. 2019. DISEÑO DE UN PLAN DE NEGOCIOS PARA EL CULTIVO, PROCESAMIENTO Y COMERCIALIZACIÓN DE CANNABIS MEDICINAL. In Monografía para optar por el título de Especialista en Gerencia de Empresas. https://doi.org/10.1017/CBO9781107415324.004
Scott, M., Rani, M., Samsatly, J., Charron, J. B. and Jabaji, S. 2018. Endophytes of industrial hemp (Cannabis sativa L.) cultivars: Identification of culturable bacteria and fungi in leaves, petioles, and seeds. Canadian Journal of Microbiology, 64(10), 664–680. https://doi.org/10.1139/cjm-2018-0108
Song, Z. Q., Cheng, F. X., Zhang, D. Y., Liu, Y. and Chen, X. W. 2017. First Report of Meloidogyne javanica Infecting Hemp (Cannabis sativa) in China. Plant Dis- ease, 101(5), 842.https://doi.org/10.1094/PDIS-10-16-1537-PDN
Szarka, D., McCulloch, M., Beale, J., Long, S., Dixon, E. and Gauthier, N. 2020. First Report of Anthracnose Leaf Spot Caused by Colletotrichum fioriniae on Hemp (Cannabis sativa). Plant Disease, 104(5), 1560. https://doi.org/10.1094/PDIS-10-19-2216-PDN
Szarka, D., Amsden, B., Beale, J., Dixon, E. and Schardl, C. L. N. G. 2020. First Report of Hemp Leaf Spot Caused by a Bipolaris Species on Hemp (Cannabis sativa) in Kentucky. Plant Health Progress, 82–84.https://doi.org/10.1094/PHP-01-20-0004-BR
Thiessen, L. 2019. Hemp Diseases in North Carolina. NC Cooperative Extension, 1–22.
Wang, S. 2018. Industrial Hemp Crop Disea- ses What We’ve Seen and What We Know. Nevada Department of Agriculture.

